INTRODUCCION
En general, los diferentes valores de electronegatividad de los átomos determinan el tipo de enlace que se formará en la molécula que los combina. Así, según la diferencia entre las electronegatividades de éstos se puede determinar (convencionalmente) si el enlace será, según la escala de Linus Pauling:
Iónico (diferencia superior o igual a 1,7)
Covalente polar (diferencia entre 1,7 y 0,4)
Covalente no polar (diferencia inferior a 0,4)
Cuanto más pequeño es el radio atómico, mayor es la energía de ionización y mayor la electronegatividad y viceversa.
Según L. Pauling, la electronegatividad es la tendencia o capacidad de un átomo, en una molécula, para atraer hacia sí los electrones. Ni las definiciones cuantitativas ni las escalas de electronegatividad se basan en la distribución electrónica, sino en propiedades que se supone reflejan la electronegatividad.
R. S. Mulliken propuso que la electronegatividad de un elemento puede determinarse promediando la energía de ionización de sus electrones de valencia y la afinidad electrónica. Esta aproximación concuerda con la definición original de Pauling y da electronegatividades de orbitales y no electronegatividades atómicas invariables
E. G. Rochow y A. L. Allred definieron la electronegatividad como la fuerza de atracción entre un núcleo y un electrón de un átomo enlazado.

los elementos representativos aumentan de izquierda a derecha en la tabla periódica, a medida que aumenta el número de electrones de valencia y disminuye el tamaño de los átomos. El flúor, de afinidad electrónica muy elevada, y cuyos átomos son pequeños, es el elemento más electronegativo y, en consecuencia, atrae a los electrones muy fuertemente.
Dentro de un grupo, la electronegatividad disminuye, generalmente, al aumentar el número y el radio atómicos. El cesio, el elemento representativo de mayor tamaño y de menor energía de ionización, es el menos electronegativo de estos elementos.
Un átomo electronegativo tiende a tener una carga parcial negativa en un enlace covalente, o a formar un ion negativo por ganancia de electrones.


ENLACE QUIMICO
Un enlace químico es la unión entre dos o más átomos para formar una entidad de orden superior, como una molécula o una estructura cristalina. Para formar un enlace dos reglas deben ser cumplidas regla del dueto y la regla del octeto.
* ENLACE IONICO:
Es la unión que se produce entre dos átomos de electronegatividades distintas, con una diferencia igual o mayor a 1.67, en este tipo de enlace ocurre una transferencia de uno o más electrones del átomo menos electronegativo hacia el más electronegativo. Por ende el átomo que cedió electrones queda con carga positiva y el que captó electrones queda con carga negativa.
El enlace iónico se presenta generalmente entre los átomos de los grupos:
I A - VII A
II A - VI A
III A - V A
*ENLACE COVALENTE:
En química, las reacciones entre dos átomos no metales producen enlaces covalentes. Este tipo de enlace se produce cuando existe una electronegatividad polar, se forma cuando la diferencia de electronegatividad no es suficientemente grande como para que se efectúe transferencia de electrones, entonces los átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital denominado orbital molecular.
*ENLACE COVALENTE SENCILLO:
Se forma cuando se comparte un par de electrones entre los átomos que forman el enlace; en otras palabras,
Enlace covalente simple: un átomo comparte con otro, un par de electrones uno con otros.(alcanos)
Enlace covalente doble: un átomo comparte con otro, 4 electrones 2 de cada átomo. (alquenos)
Enlace covalente triple: Cuando un átomo comparte con otro, 6 electrones 3 de cada átomo.(alquino)
Cuando no existe suficiente diferencia de electronegatividad para que exista transferencia electrónica, resultan dos átomos compartiendo uno o más pares de electrones y forman una molécula con energía de atracción débil en resultado poseen bajos puntos de fusión y ebullición en comparación con los iónicos. Los enlaces pueden ser simple, doble y triple, según la forma de compartir uno, dos o tres electrones.
La energía de las fuerzas de atracción o repulsión entre los elementos que conforman un enlace iónico es función de la distancia internuclear llegando a una distancia mínima donde se compensa las fuerzas de atracción y de repulsión, la cual se denomina distancia de enlace.
*ENLACE VAN DER WAALS:
Las fuerzas de van der Waals son fuerzas de estabilización molecular; forman un enlace químico no covalente en el que participan dos tipos de fuerzas o interacciones, las fuerzas de dispersión (que son fuerzas de atracción) y las fuerzas de repulsión entre las capas electrónicas de dos átomos contiguos.

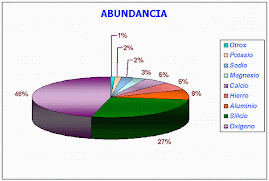
EN LA SIGUIENTE TORTA VAMOS A ENCONTRAR CUANTA ELECTRONEGATIVIDAD POSEE ALGUNOS ELEMENTOS DE LA TABLA PERIODICA.